نیم نگاهی به تاریخچه و استفاده های سود پرک در صنعت
۰۷ آذر ۱۳۹۹ سود پرک ، مواد شیمیایی ، مقالات شیمی تاریخچه کامل هیدروکسید سدیم ، مهمترین استفاده های هیدروکسید سدیم در صنعت ، مقاله ای جامع درباره سود پرک ، آیا هیدروکسید سدیم خورندگی دارد ، تاریخچه و استفاده های سود پرک ، قدمت سود پرک ، خورندگی هیدروکسید سدیم
تاریخچه سود پرک
عکسی قدیمی از نخستین مخازن سود سوزآور در ویرجینیا
مروری بر کاربرد و تاریخچه هیدروکسید سدیم
مهمترین کاربردهای هیدروکسید سدیم در صنعت
نیم نگاهی به تاریخچه و استفاده های سود پرک در صنعت خواهیم داشت و پس از بررسی همه ابعاد سود پرک مروری داریم بر مهمترین استفاده های هیدروکسید سدیم در صنعت ، هیدروکسید سدیم این روزها تقریبا با بیشتر صنایع عجین شده است و با توجه به ارزشمند بودن این محصول و نسبت به قیمت پایین آن ، مورد نیاز بسیاری از صنایع است ، به همین منظور بر آن شدیم که مقاله ای جامع درباره سود پرک یا همان هیدروکسید سدیم جامد را ارائه دهیم . با پرک شیمی همراه باشید تا این ماده کاربردی و ارزشمند را از همه ابعاد بررسی کنیم .
خواندن مقاله زیر به درک بهتر موضوع کمک می کند :
چرا سود پرک ؟
سود پرک | سود سوزآور | هیدروکسید سدیم جامد | Caustic soda flakes
آنچه در این مقاله خواهید خواند :
• تاریخچه سود پرک
• روش های تولید هیدروکسید سدیم
• کاربردهای هیدروکسید سدیم
• استفاده از سود پرک در مصارف مختلف
• اطلاعات ایمنی
• جمع بندی
مقدمه
هیدروکسیدسدیم یا سودسوزآور یک ماده بلوری سفید و بدون بو می باشد،این ماده یک باز قوی محسوب می شود و با عنوان هیدرات سدیم نیز شناخته می شود. هیدروکسید سدیم به صورت جامد و مایع وجود دارد ، هیدروکسیدسدیم جامد به صورت پولک ،پودر و گرانول تولید می شود . بسته به شکل ظاهری و خلوص آن ، در صنایع مختلف مورد استفاده قرار می گیرد .گرانول آن معمولا خلوص بالاتری دارد ، بنابراین در صنایع حساس تری مانند داروسازی مورد استفاده قرار می گیرد .
واکنش جذب رطوبت توسط سودسوزآور ، بسیار گرمازا است و بنابراین باعث پاشیدن آب در اطراف می شود ، از این رو هنگام کار با آن باید نکات ایمنی را رعایت کنیم . هیدروکسیدسدیم با برخی از فلزات مانند آلومینیم واکنش داده و گاز هیدروژن تولید می کند ، همچنین با دی اکسید گوگرد واکنش داده واثر تولید گازهای سمی و مضر مانند H2Sو SO2 را که معمولا از سوختن زغال سنگ به دست می آیند ، از بین می برد ، در نتیجه سودسوزآور میتواند از انتشار این گازهای سمی در جو جلوگیری کند.
خورندگی هیدروکسید سدیم
آیا هیدروکسید سدیم خورندگی دارد ؟ بله ، هیدروکسیم سدیم بسیار خورنده است ، خورندگی آن بر روی آلومینیم و روی بسیار زیاد است و خورندگی کمی برای سرب و قلع دارد اما روی فلزات دیگر تأثیر نمی گذارد . هیدروکسیدسدیم در فرآیندهای سنتز ترکیبات آلی ، در پالایشگاه ها ، صنایع نساجی ، کاغذ کارتن سازی ، درساخت صابون ، درتولید آلومینیم ، صنایع غذایی و… کاربرد فراوانی دارد.هدف اصلی تولید و استفاده از این ماده در درجه اول بهره مندی از خاصیت چربی زدایی آن می باشد.
تاریخچه ی سود پرک
درباره قدمت سود پرک باید اظهار داشت که هیدروکسیدسدیم توسط Humphrey Day دانشمند انگلیسی در سال 1807میلادی کشف شد ، جالب است بدانید که حادثه یا آزمایشی که منجر به کشف هیدروکسیدسدیم شد ، ناشناخته مانده است . این ماده برای مدتی ، تا چند سال بعد از کشف آن به عنوان یک ماده اولیه بنام قلیایی شناخته می شد . باید یادآور شد که هیدروکسیدسدیم مدتها قبل از شناسایی ، مورد استفاده قرار می گرفت . در زمان مصریان باستان و بابلی ها ، با استفاده از خاکستر سبزیجات با آب ، محلول ضعیفی از این ماده تولید می شد . یکی از شواهد تاریخی مهم که حکایت از قدمت این ماده را در خود دارد ، مخلوطی است از آب قلیایی همراه با روغن زیتون برای تولید یک محصول که بر روی یک لوح سفالی با قدمت حدود 4800 سال ، استفاده شده است .
روشهای تولید هیدروکسیدسدیم
هیدروکسیدسدیم یا سودسوزآور یک باز قوی به حساب می آید و به طور کلی به صورت جامد یا محلول 5% تولید می شود ، از آن جایی که این ماده ارزان است ، به طور گسترده مورد استفاده قرار می گیرد و بیشتر به عنوان یک ماده شیمیایی و در ساخت سایر مواد شیمیایی به کار برده می شود . کاربرد اصلی هیدروکسیدسدیم چربی زدایی می باشد . هیدروکسیدسدیم با چربی ها ، یک ماده محلول بوجود می آورد که در آب قابل حل می باشد ، از این رو چربی زدایی ، بسیار قوی می باشد.
کاربرد اصلی هیدروکسید سدیم چربی زدایی است .
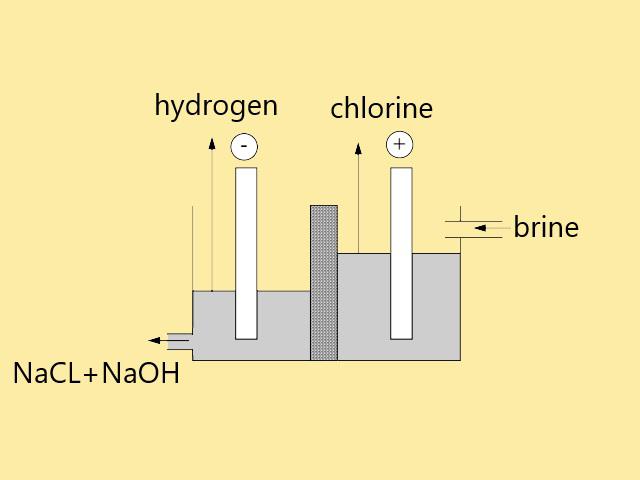
انواع روشهای تولید هیدروکسیدسدیم
روش اصلی برای تولید هیدروکسیدسدیم ، تفکیک الکترولیتی سدیم است ، از الکترولیز محلول غلیظ سدیم کلرید ،گاز کلر، گازهیدروژن و محلول هیدروکسیدسدیم تولید می شود(محصولات مشترک حاصل از تولیدالکترولیتی ، سودسوزآور ، کلر و هیدروژن هستند).هیدروکسید سدیم در کاتد جمع می شود . جایی که آب به گاز هیدوژن و یون هیدروکسیل تبدیل می شود و نمک سوزآور رقیق شده از سلول خارج می شود(الکترود منفی).گاز کلر نیز در آند تولید می شود(الکترود مثبت).
(2Nacl(aq)+2H2O(l)→H2(q)+CL2(q)+2NaOH(aq
3 نوع سل الکترولیتی برای تولید هیدروکسیدسدیم از نمک مورداستفاده قرارمی گیرد:
( فرآیند مرکوری ) Caster – Kellner Cell
Nelson Diaphragm Cell
Membrane Cell
تقریبا همه ی سودسوزآور با الکترولیز محلول کلریدسدیم با استفاده از یکی از 3 نوع سلول ذکر شده ، تولید می شود . ماده ی اولیه ای که مورد استفاده قرار می گیرد ، نمک معمولی است ، محلول کلریدسدیم را اغلب نمک (brine) می نامند ، به طور سنتی ، الکترولیز توسط سل دیافراگم آمالگام جیوه انجام می شود ، اماسلول غشای تبادل یونی از نظر محیطی و اقتصادی بیشتر مورد استفاده قرار می گیرد. در ایالات متحده آمریکا از طریق سلول دیافراگم ، و در اروپا سلول های جیوه و غشایی بیشتر مورد استفاده قرار می گیرد. در سلول جیوه سدیم به صورت یون آمالگام سدیم جیوه و کلرید به صورت کلر تخلیه می شود .
آمالگام به یک محفظه کاملا جداگانه منتقل می شود و در آنجا با آب واکنش می دهد و محلول هیدروکسیدسدیم و گاز هیدروژن تولید می شود. وجود گاز کلر و جیوه باعث آلودگی هوا خواهد شد، اما محصول حاصل از این روش ، بسیار خالص می باشد و عیاری بالا خواهد داشت. سلول دیافراگم معمولا از آزبست تولید می شود، جریان آب نمک را از آند به کاتد عبور میدهد، اما فضای گاز کلر و گاز هیدروژن را از هم جدا می کند.با تخلیه ی یون های هیدوژن، یون های هیدروکسید در محفظه کاتد با یون سدیم آبی جمع می شوند و هیدروکسیدسدیم تولید می کنند. مهاجرت یون های هیدروکسید از کاتد به آند با سرعت جریان مایع از یک محفظه به محفظه دیگر جلوگیری می شود.
کلر تشکیل شده در آندها از طریق آب نمک به یک فضای تشکیل شده توسط سلول پوششی افزایش می یابد ، اما محصول بدست آماده به علت وجود ناخالصی ، عیار کمتری خواهد داشت.در فرایند غشایی ،غشای تبادل یونی به عنوان سدی در برابر تمام جریان های گاز و مایع عمل می کند و فقط اجازه عبور یون های سدیم را از بین محفظه ها می دهد.یونهای سدیم به صورت هیدراته عبور می کند و در کاتدی که هیدروژن از آن خارج می شود،هیدروکسیدسدیم تولید می شود،گاز کلر در آن آزاد می شود.
غشاء یک کوپلیمر، تترافلوئور اتیلن یا یک مونومر فلورین مشابه است . سلول های جیوه ارزان تر از سلول های دیافراگمی هستند هزینه ی برق کمتری دارند و محصولی با غلظت و خلوص بالا تولید می شود،اما باید جیوه را از پساب خارج کرد.سلول های دیافراگمی به مقدار زیادی انرژی گرمایی نیاز دارند تا محلول غلیظ تری به دست آید اما در صورت کم بودن بخار و ساختار می توانند از سلول های جیوه ای ارزان تر باشند.استفاده از سلول های غشایی به دلیل کاهش سرمایه و هزینه های انرژی و عدم وجود مشکلات زیست محیطی در حال رشد است.روش دیگری نیز برای تولید هیدروکسیدسدیم با خلوص پایین وجود دارد،در این روش از سنگ ترونا که مخلوطی از کربنات سدیم با آهک،برای تولید هیدروکسیدسدیم استفاده می شود.
خواص شمیایی و فیزیکی هیدروکسیدسدیم
فرمول شیمیایی : NaOH
نقطه جوش : 1390ºc
دانسیته : gr/ml 2.13
جرم مولکولی : 39.99 gr/mol
نام های مشابه : کاستیک سودا،سدیم هیدرات ،Sodalye
حلالیت : قابل انحلال در آب ، اتانول و گلسیرول و نا محلول در استون و اتر
هیدروکسیدسدیم جامد بلوری ، سفید و بدون بو می باشد که رطوبت هوا را جذب می کند، هنگامی که در آب حل می شود یا با اسید خنثی می شود گرمای قابل توجهی آزاد می کند که ممکن است برای اشتعال مواد قابل احتراق کافی باشد . هیدروکسیدسدیم بسیار خورنده است و به طور کلی به صورت جامد یا محلول 50% استفاده می شود. یک باز قوی است و به آسانی با اسید هایی مانند اسید هیدروکلریک واکنش می دهد و نمک های مربوطه را تشکیل می دهد.
NaOH+HCL→NaCl+H2O
سودسوزآور برای آلومینیم و روی بسیار خورنده می باشد و خوردگی کمی برای سرب و قلع دارد و روی فلزات دیگر تاثیر نمی گذارد.
هیدروکسید سدیم واکنش پذیری خوبی با فلزات و اسیدها دارد به عنوان مثال در حذف گازهای خطرناک مثل دی اکسیدگوگرد(SO2)میتوان از هیدروکسیدسدیم استفاده کرد.همچنین برای رسوب دادن فلزات به صورت هیدروکسید از آب،می توان از سوپرپرک استفاده کرد.



